JAMA Oncology (IF 33.012) offentliggjorde for nylig et vigtigt forskningsresultat [1] af teamet bestående af professor Cai Guo-ring fra Cancer Hospital ved Fudan University og professor Wang Jing fra Renji Hospital ved Shanghai Jiao Tong University School of Medicine, i samarbejde med KUNYUAN BIOLOGY: “Tidlig detektion af molekylær restsygdom og risikostratificering for stadium I til III kolorektal kræft via cirkulerende tumor-DNA-methylering og risikostratificering)”. Dette studie er det første multicenterstudie i verden, der anvender PCR-baseret blod-ctDNA-multigenmetyleringsteknologi til forudsigelse og overvågning af recidiv af kolorektal kræft, hvilket giver en mere omkostningseffektiv teknisk vej og løsning sammenlignet med eksisterende MRD-detektionsteknologimetoder, hvilket forventes at forbedre den kliniske anvendelse af forudsigelse og overvågning af recidiv af kolorektal kræft betydeligt og forbedre patienters overlevelse og livskvalitet betydeligt. Undersøgelsen blev også i høj grad evalueret af tidsskriftet og dets redaktører og blev opført som en vigtig anbefaling i dette nummer, og professor Juan Ruiz-Bañobre fra Spanien og professor Ajay Goel fra USA blev inviteret til at anmelde den. Undersøgelsen blev også rapporteret af GenomeWeb, et førende biomedicinsk medie i USA.

Kolorektal kræft (CRC) er en almindelig ondartet tumor i mave-tarmkanalen i Kina. Data fra Det Internationale Agentur for Kræftforskning (IARC) fra 2020 viser, at 555.000 nye tilfælde i Kina tegner sig for omkring 1/3 af verdens befolkning, hvor incidensraten stiger til andenpladsen blandt almindelige kræftformer i Kina. 286.000 dødsfald tegner sig for omkring 1/3 af verdens befolkning, hvilket er den femte hyppigste årsag til kræftdødsfald i Kina. Den femte hyppigste dødsårsag i Kina. Det er bemærkelsesværdigt, at blandt de diagnosticerede patienter er TNM-stadier I, II, III og IV henholdsvis 18,6 %, 42,5 %, 30,7 % og 8,2 %. Mere end 80 % af patienterne er i de midterste og sene stadier, og 44 % af dem har samtidige eller heterokroniske fjernmetastaser til lever og lunge, hvilket alvorligt påvirker overlevelsesperioden, bringer vores beboeres helbred i fare og forårsager en tung social og økonomisk byrde. Ifølge statistikker fra National Cancer Center er den gennemsnitlige årlige stigning i omkostningerne ved behandling af kolorektal cancer i Kina omkring 6,9 % til 9,2 %, og patienters personlige sundhedsudgifter inden for et år efter diagnosen kan udgøre 60 % af familiens indkomst. Kræftpatienter lider af sygdommen og er også under stort økonomisk pres [2].
Halvfems procent af kolorektal cancer-læsioner kan fjernes kirurgisk, og jo tidligere tumoren opdages, desto højere er femårsoverlevelsesraten efter radikal kirurgisk resektion, men den samlede recidivrate efter radikal resektion er stadig omkring 30%. Femårsoverlevelsesraterne for kolorektal cancer i den kinesiske befolkning er henholdsvis 90,1%, 72,6%, 53,8% og 10,4% for stadie I, II, III og IV.
Minimal residual disease (MRD) er en væsentlig årsag til tumorrecidiv efter radikal behandling. I de senere år har MRD-detektionsteknologien for solide tumorer udviklet sig hurtigt, og adskillige tunge observations- og interventionsstudier har bekræftet, at postoperativ MRD-status kan indikere risikoen for postoperativ recidiv af kolorektal cancer. ctDNA-testning har fordelene ved at være ikke-invasiv, enkel, hurtig, med høj prøvetilgængelighed og ved at overvinde tumorheterogenitet.
Både de amerikanske NCCN-retningslinjer for tyktarmskræft og de kinesiske CSCO-retningslinjer for kolorektal cancer angiver, at ctDNA-testning kan give prognostiske og prædiktive oplysninger, der kan hjælpe med at træffe beslutninger om adjuverende behandling for patienter med stadium II eller III tyktarmskræft. De fleste eksisterende studier fokuserer dog på ctDNA-mutationer baseret på high-throughput sequencing technology (NGS), som har en kompleks proces, lang gennemløbstid og høje omkostninger [3], med en let mangel på generaliserbarhed og lav prævalens blandt kræftpatienter.
For patienter med kolorektal cancer i stadium III koster dynamisk ctDNA-monitorering baseret på NGS op til $10.000 for et enkelt besøg og kræver en ventetid på op til to uger. Med multigenmetyleringstesten i dette studie, ColonAiQ®, kan patienter få dynamisk ctDNA-monitorering til en tiendedel af prisen og få en rapport på så lidt som to dage.
Ifølge de 560.000 nye tilfælde af kolorektal kræft i Kina hvert år har de kliniske patienter, primært med stadium II-III kolorektal kræft (andelen er omkring 70%), et større presserende behov for dynamisk monitorering, end markedet for dynamisk MRD-monitorering af kolorektal kræft når millioner af mennesker hvert år.
Det kan ses, at forskningsresultaterne har vigtig videnskabelig og praktisk betydning. Gennem store prospektive kliniske studier har det bekræftet, at PCR-baseret blod-ctDNA multigenmethyleringsteknologi kan bruges til forudsigelse og overvågning af recidiv af kolorektal cancer med både følsomhed, aktualitet og omkostningseffektivitet, hvilket bedre gør det muligt for flere kræftpatienter at få gavn af præcisionsmedicin. Studiet er baseret på ColonAiQ®, en multigenmethyleringstest til kolorektal cancer udviklet af KUNY, hvis kliniske anvendelsesværdi i tidlig screening og diagnose er blevet bekræftet af et centralt klinisk studie.
Gastroenterology (IF33.88), det førende internationale tidsskrift inden for gastrointestinale sygdomme i 2021, rapporterede multicenterforskningsresultaterne fra Zhongshan Hospital ved Fudan University, Cancer Hospital ved Fudan University og andre autoritative medicinske institutioner i samarbejde med KUNYAN Biological, som bekræftede ColonAiQ® ChangAiQ®s fremragende præstation i tidlig screening og tidlig diagnose af kolorektal cancer, og udforskede i første omgang også den potentielle anvendelse i prognostisk overvågning af kolorektal cancer.
For yderligere at validere den kliniske anvendelse af ctDNA-methylering i risikostratificering, vejledning af behandlingsbeslutninger og tidlig recidivmonitorering i stadium I-III kolorektal cancer, inkluderede forskerholdet 299 patienter med stadium I-III kolorektal cancer, som gennemgik radikal kirurgi og indsamlede blodprøver ved hvert opfølgningspunkt (tre måneder fra hinanden) inden for en uge før operationen, en måned efter operationen og i postoperativ adjuverende behandling til dynamisk blod-ctDNA-testning.
For det første blev det konstateret, at ctDNA-testning kunne forudsige risikoen for recidiv hos patienter med kolorektal cancer tidligt, både præoperativt og tidligt postoperativt. Præoperative ctDNA-positive patienter havde en højere sandsynlighed for postoperativ recidiv end præoperative ctDNA-negative patienter (22,0 % > 4,7 %). Tidlig postoperativ ctDNA-testning forudsagde stadig risikoen for recidiv: en måned efter radikal resektion var ctDNA-positive patienter 17,5 gange mere tilbøjelige til at recidive end negative patienter. Teamet fandt også, at kombineret ctDNA- og CEA-testning forbedrede præstationen i at detektere recidiv en smule (AUC = 0,849), men forskellen var ikke signifikant sammenlignet med ctDNA-testning (AUC = 0,839) alene. Forskellen var ikke signifikant sammenlignet med ctDNA alene (AUC = 0,839).
Klinisk stadieinddeling kombineret med risikofaktorer er i øjeblikket det primære grundlag for risikostratificering af kræftpatienter, og i det nuværende paradigme får et stort antal patienter stadig recidiv [4], og der er et presserende behov for bedre stratificeringsværktøjer, da overbehandling og underbehandling sameksisterer i klinikken. Baseret på dette klassificerede teamet patienter med stadium III kolorektal cancer i forskellige undergrupper baseret på klinisk vurdering af recidivrisiko (høj risiko (T4/N2) og lav risiko (T1-3N1)) og adjuverende behandlingsperiode (3/6 måneder). Analysen viste, at patienter i højrisiko-undergruppen af ctDNA-positive patienter havde en lavere recidivrate, hvis de fik seks måneders adjuverende behandling; i lavrisiko-undergruppen af ctDNA-positive patienter var der ingen signifikant forskel mellem den adjuverende behandlingscyklus og patientresultater; mens ctDNA-negative patienter havde en signifikant bedre prognose end ctDNA-positive patienter og en længere postoperativ recidivfri periode (RFS); stadium I og lavrisiko stadium II kolorektal cancer. Alle ctDNA-negative patienter havde intet recidiv inden for to år; Derfor forventes integrationen af ctDNA med kliniske træk yderligere at optimere risikostratificering og bedre forudsige recidiv.
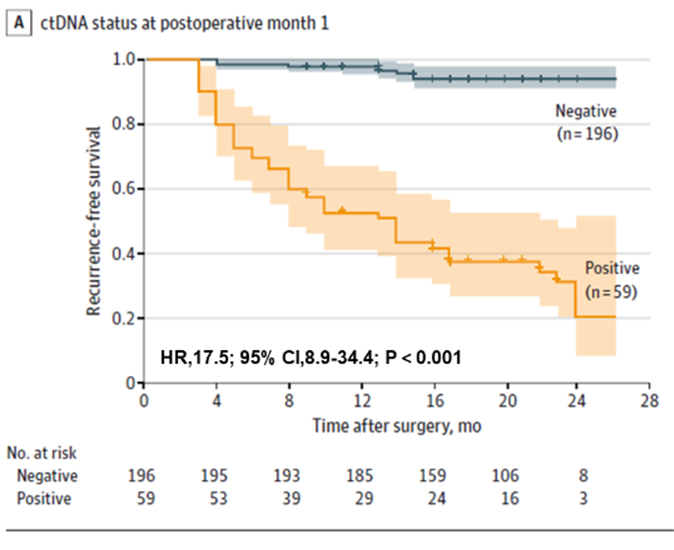
Figur 1. Plasma-ctDNA-analyse ved POM1 til tidlig påvisning af recidiv af kolorektal cancer
Yderligere resultater af dynamisk ctDNA-testning viste, at risikoen for recidiv var signifikant højere hos patienter med positiv dynamisk ctDNA-testning end hos patienter med negativ ctDNA i løbet af overvågningsfasen for sygdomsrecidiv efter definitiv behandling (efter radikal kirurgi + adjuverende behandling) (Figur 3ACD), og at ctDNA kan indikere tumorrecidiv op til 20 måneder tidligere end billeddiagnostisk undersøgelse (Figur 3B), hvilket giver mulighed for tidlig påvisning af sygdomsrecidiv og rettidig intervention.
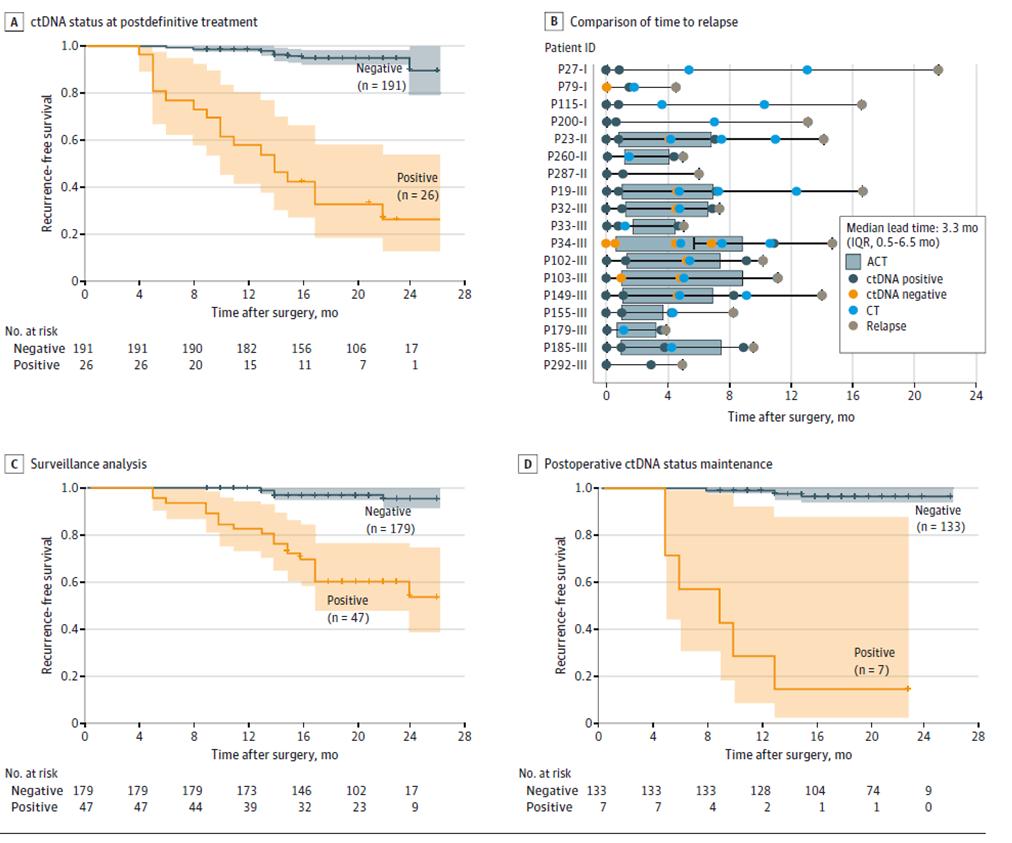
Figur 2. ctDNA-analyse baseret på longitudinel kohorte til at detektere recidiv af kolorektal cancer
"Et stort antal translationelle medicinske studier i kolorektal cancer er førende inden for disciplinen, især ctDNA-baseret MRD-testning viser et stort potentiale til at forbedre postoperativ behandling af patienter med kolorektal cancer ved at muliggøre stratificering af risikoen for recidiv, vejlede behandlingsbeslutninger og tidlig overvågning af recidiv."
Fordelen ved at vælge DNA-methylering som en ny MRD-markør frem for mutationsdetektion er, at den ikke kræver helgenomsekventeringsscreening af tumorvæv, bruges direkte til blodprøver og undgår falsk-positive resultater på grund af detektion af somatiske mutationer, der stammer fra normalt væv, godartede sygdomme og klonal hæmatopoiese.
Dette studie og andre relaterede studier bekræfter, at ctDNA-baseret MRD-testning er den vigtigste uafhængige risikofaktor for recidiv af stadium I-III kolorektal cancer og kan bruges til at hjælpe med at vejlede behandlingsbeslutninger, herunder "eskalering" og "nedgradering" af adjuverende behandling. MRD er den vigtigste uafhængige risikofaktor for recidiv efter operation for stadium I-III kolorektal cancer.
MRD-feltet er i hastig udvikling med en række innovative, yderst følsomme og specifikke assays baseret på epigenetik (DNA-methylering og fragmentomik) og genomik (ultradybende målrettet sekventering eller helgenomsekventering). Vi forventer, at ColonAiQ® fortsætter med at organisere store kliniske studier og kan blive en ny indikator for MRD-testning, der kombinerer tilgængelighed, høj ydeevne og overkommelige priser, og som kan anvendes i vid udstrækning i rutinemæssig klinisk praksis.
Referencer
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Tidlig påvisning af molekylær restsygdom og risikostratificering for stadium I til III kolorektal cancer via cirkulerende tumor-DNA-methylering. JAMA Oncol. 2023 20. april.
[2] “Byrden af kolorektal cancer i den kinesiske befolkning: har den ændret sig i de senere år?”, Chinese Journal of Epidemiology, bind 41, nr. 10, oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V m.fl. Målrettet næstegenerationssekventering af cirkulerende tumor-DNA til sporing af minimal residual sygdom i lokaliseret tyktarmskræft. Ann Oncol. 1. november 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Forfining af adjuverende behandling til ikke-metastatisk tyktarmskræft, nye standarder og perspektiver. Cancer Treat Rev. 2019;75:1-11.
Opslagstidspunkt: 28. april 2023
 中文网站
中文网站